La enfermedad del Mal de Chagas-Mazza está ampliamente
esparcida por América latina, exactamente en 21 países entre los que está el
Ecuador. El país tiene zonas endémicas
en la costa y amazonía, así como en la
provincia de Loja y algunas regiones subtropicales de la sierra.
En el continente se estima que hay 10 millones de personas que padecen este mal y en Ecuador serían unos 300 mil infectados,
según el Centro de Investigación de Enfermedades Infecciosas y Crónicas (CIEI) de
la Pontificia Universidad Católica del Ecuador (PUCE). La entidad
investiga el parásito para ver su correlación en el país con el desarrollo del
Mal de Chagas-Mazza, ya que 3,8 millones de personas corren riesgo de padecer
la enfermedad. Solo entre el 25 y el 30 por ciento de los infectados por
el t.cruzi desarrollan Chagas-Mazza.
 |
| Foto: PAHO |
 |
| Foto: PAHO |
El Mal de Chagas-Mazza es de las enfermedades transmitidas por
un vector, en este caso son los insectos triatominos, vulgarmente conocido como
chinchorro o chinche, que puede
colonizar casas mal construidas en zonas rurales, sub urbanas y urbanas (se
instalan en grietas o ranuras). Éste no es más que el transmisor del parásito tripanosoma cruzi, que pasa al
ser humano a través de las heces del insecto que defeca al picar a su víctima. Otras maneras de contraer el Mal de Chagas-Mazza
es a través de transplante de órganos, transfusiones de sangre o durante el
embarazo de la madre al hijo.
 |
| picadura de insecto |
A pesar de la cantidad de personas afectadas, no es una
enfermedad ampliamente conocida y muchas veces las personas no saben que están
infectadas. No existe cura ni vacuna (por el momento, ya que está en
desarrollo) cuando la enfermedad está en su etapa crónica. La prevención sigue siendo la mejor arma contra este mal.
La enfermedad tiene dos etapas: aguda (puede ser
asintomática o manifestar fiebre y malestar), y crónica ( suele aparece luego
de 20 o 30 años). Si se administran medicamentos en la etapa aguda la
enfermedad es reversible.
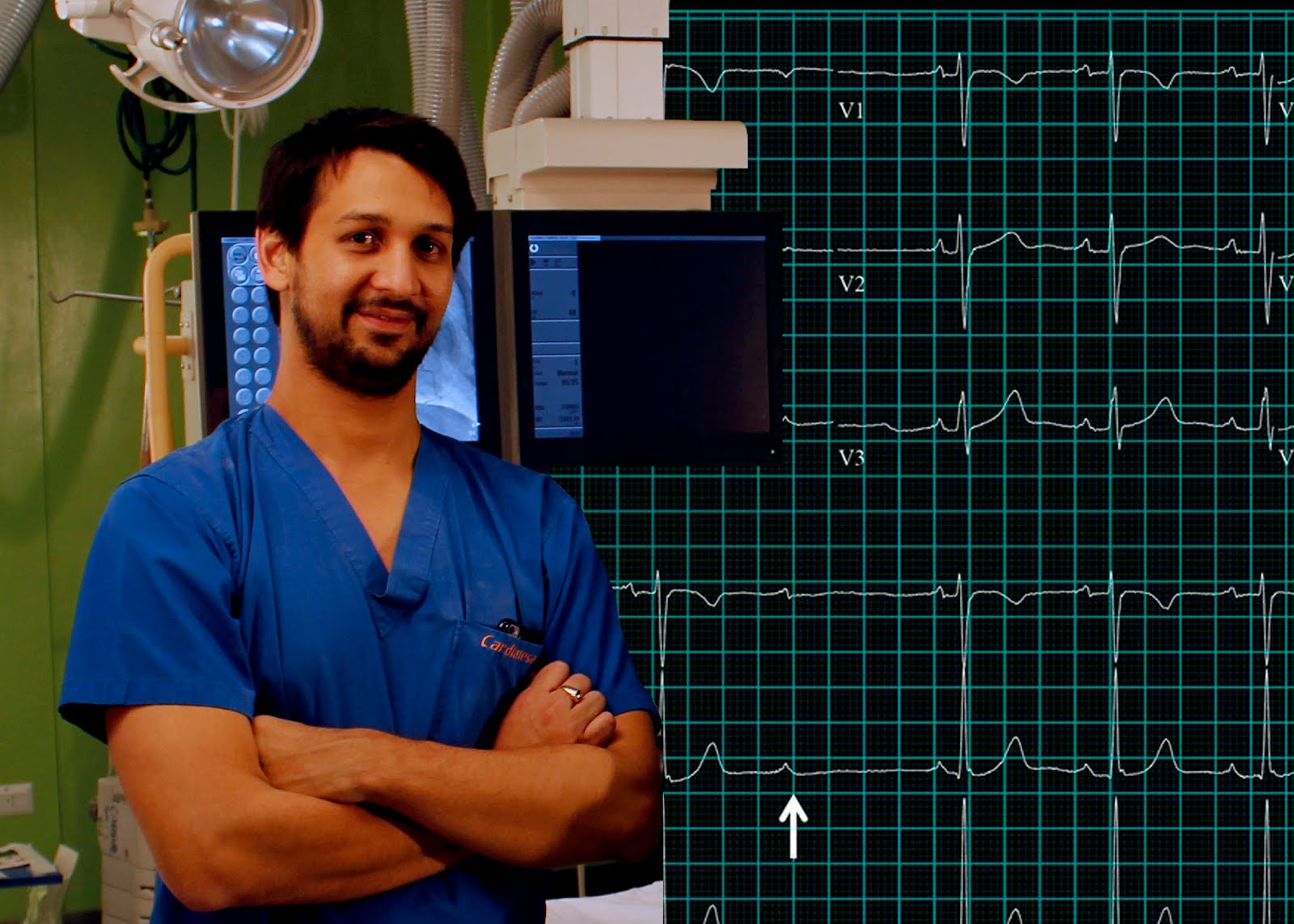
La última etapa es en la que ahondaremos más, ya que es en
la que el cardiólogo interviene. Un 30
por ciento de los infectados desarrolla problemas cardíacos (los daños se producen de manera continua y
lenta), también el paciente desarrolla problemas en el sistema nervioso y digestivo.
El Mal de Chagas-Mazza hace que ciertos órganos, como el
corazón, el colon o el esófago, se agranden.
El corazón agrandado
por el Chagas produce cardiomegalias y bloqueos en el sistema de conducción
eléctrica. La Organización Panamericana de la Salud dice que alrededor del
30 por ciento de los pacientes chagásicos van a desarrollar: miocardipatías,
alteraciones en el ritmo y conducción del corazón (estas arritmias pueden
derivar en muerte súbita), aneurisma apical, insuficiencia cardíaca por la destrucción
progresiva del músculo cardíaco. Entre
los síntomas que aparecen en esta etapa se encuentran mareos, palpitaciones,
fatigas, pérdida de conocimiento y falta de aire. La dilatación del corazón es
mucho más común que la del colon y esófago que solo el 10 por ciento la sufren.
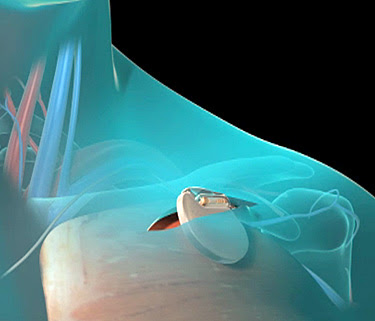
Las complicaciones derivadas del agrandamiento del órgano
cardíaco se combaten con su respectivo tratamiento, que puede ser
antiarrítmicos, diuréticos, vasodilatadores, anticoagulantes. En algunos casos
es necesario el implante de dispositivos cardíacos como marcapasos o
cardiodefibriladores.